蓄电池充电的过程,本质上是电能转化为化学能的过程。

(图片来源网络,侵删)
下面我们来详细解释一下这个转化过程:
核心答案
-
输入能:电能
这是由外部电源(如充电器、发电机、太阳能电池板等)提供的,在微观上,是定向移动的自由电子。
-
输出能(储存能):化学能
 (图片来源网络,侵删)
(图片来源网络,侵删)这是指储存在蓄电池内部,电极和电解液中的化学物质所具有的能量,这种能量以化学键的形式存在,是一种稳定的、高密度的能量形式。
详细过程解析
可以把蓄电池想象成一个“能量仓库”,而充电就是往这个仓库里“进货”能量。
蓄电池的组成: 一个基本的蓄电池(以最常见的铅酸电池为例)由:
- 正极板: 主要材料是二氧化铅 (PbO₂)
- 负极板: 主要材料是海绵状铅
- 电解液: 稀硫酸 (H₂SO₄) 水溶液
- 隔板: 防止正负极直接接触短路
充电时的能量转化步骤:
(图片来源网络,侵删)
-
施加外部电压: 当你将充电器连接到蓄电池的正负极时,充电器会施加一个比蓄电池自身电压稍高的直流电压,这个电压会强制形成一个与放电时方向相反的电流。
-
强制发生逆向化学反应:
-
在负极(阴极): 外部电源的负极会“推”出电子,这些电子通过外部电路到达蓄电池的负极板,这些多余的电子会强制与负极板上的活性物质(海绵状铅,Pb)和电解液中的硫酸根离子(SO₄²⁻)发生反应,生成不溶于硫酸的硫酸铅(PbSO₄),并释放出两个电子。
- 反应式:
Pb + SO₄²⁻ - 2e⁻ → PbSO₄ - 简单理解: 得到了电子,铅单质变成了硫酸铅。
- 反应式:
-
在正极(阳极): 外部电源的正极会从正极板“抽走”电子,这导致正极板上的二氧化铅(PbO₂)和电解液中的氢离子(H⁺)与硫酸根离子(SO₄²⁻)发生反应,也生成硫酸铅(PbSO₄),同时水(H₂O)。
- 反应式:
PbO₂ + 4H⁺ + SO₄²⁻ + 2e⁻ → PbSO₄ + 2H₂O - 简单理解: 失去了电子,二氧化铅也变成了硫酸铅。
- 反应式:
-
-
能量储存:
- 经过上述逆向反应,原本放电后生成的、覆盖在电极表面的硫酸铅(PbSO₄)被重新“还原”回了原来的活性物质:负极的海绵状铅和正极的二氧化铅。
- 这个“还原”过程需要消耗能量,这些能量就以化学能的形式,被重新储存在电极材料的内部结构中,当电极材料的化学成分恢复到“满电”状态时,充电就完成了。
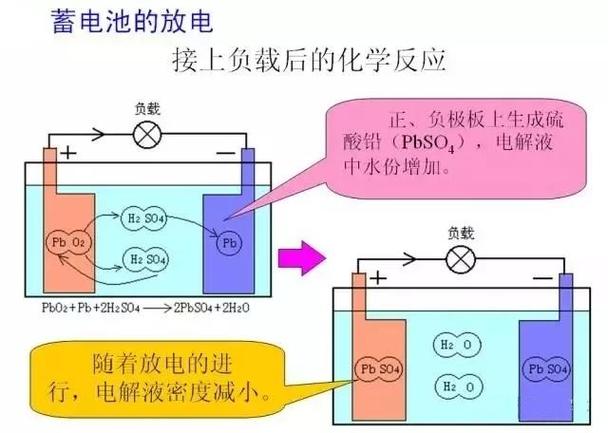
放电时的能量转化(作为对比)
为了更好地理解充电,我们可以看看它的逆过程——放电:
- 转化过程:化学能 → 电能
- 工作方式: 当蓄电池连接到用电器(如汽车启动马达)时,电池内部的化学反应自发进行。
- 化学反应:
- 负极的铅(Pb)失去电子,通过外部电路流向正极。
- 正极的二氧化铅(PbO₂)得到电子,与电解液反应。
- 能量释放: 这个自发化学反应驱动电子定向移动,形成电流,为用电器提供电能,储存在电池里的化学能被释放出来,转化成了我们需要的电能。
| 过程 | 能量转化 | 关键特征 |
|---|---|---|
| 充电 | 电能 → 化学能 | 外部提供电能,强制发生逆向化学反应,将能量储存起来。 |
| 放电 | 化学能 → 电能 | 电池自发进行化学反应,释放储存的化学能,对外输出电能。 |
充电就是用“电”把电池里的“化学物质”恢复到高能量状态的过程,从而把电能以化学能的形式存起来。




